斑馬魚的基因與人類相似度高達87%,可以很好地為生物學家和醫生研究各種疾病提供幫助。右上圖為斑馬魚胚胎,右下圖為人類早期胚胎。

斑馬魚僅有三到四釐米長。它身軀玲瓏而纖細,卻具有頑強的生命力。而且,這小魚兒竟然和人類基因有著高度同源性。
這給科學界帶來意外驚喜,科學家們想到了讓它替人類篩選藥物。於是,小魚兒從此踏上為人類“替難”之旅。
日前,筆者在廣州舉行的全國第二屆斑馬魚學術研討會上了解到,通過斑馬魚平均每篩選250種藥物,就有一種能走向市場。這樣的效率,是傳統細胞模型藥物篩選辦法的4000倍。
斑馬魚的身體小、作用大,因此其本身也成為科學研究的熱點。據介紹,如今幾乎每個月都有四五篇以斑馬魚為研究主角的論文在世界性的學術期刊發表。越來越多的科學家對斑馬魚寄予厚望,希望它們能為人類篩選出更多的有效藥物。
細胞篩藥就像要轉三次地鐵:第一站是篩選出適合細胞的藥物,第二站轉乘,將藥物注入到動物身上,第三站是檢驗藥物的長期適用性;而斑馬魚篩藥的特點是“直飛”,作用目標明確,效果可評估,沒有“中轉站”
●南方日報記者 曹斯 實習生 周馮燦 通訊員 張淼 鄒瑩 統籌 林亞茗
1
模式生物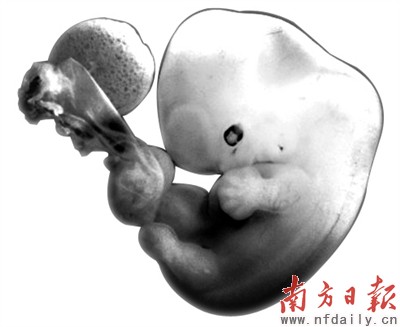
迄今已鑒定8000多種斑馬魚突變體,其中1/4成為人類疾病模型,可模擬貧血、耳聾、視網膜變性、肌無力症、惡性腫瘤和阿爾茨海默病等多種人類疾病
斑馬魚(Zebrafish)生於高溫潮濕的南亞地帶。它們身上附帶著美麗的暗藍與銀色縱條紋,繁殖力非常高。
有一次,美國俄勒岡大學著名遺傳學家George Streisinger從寵物店裏買回斑馬魚作觀賞。這位科學家偶然對這身長不過3—4釐米的熱帶小魚感興趣起來。
他研究了小魚的卵裂特點、胚胎發育規律,發現其胚體透明而且發育速度快的特徵,就想到斑馬魚也許可以用來做“模式生物”,也就是可用於解釋生命一般規律的生物體。
據南方醫科大學基礎醫學院張文清教授介紹,斑馬魚作為模式生物的優勢很突出,它與人的基因相似度高達87%,這意味著其實驗結果大多數情況下適用於人體。而且,斑馬魚3個月便可成熟,一次可產200—400枚卵,一週產一次,這意味著小魚的培育週期非常短。“目前,斑馬魚是國際標準化組織認可的五種魚類實驗動物之一,成為發育生物學、遺傳學、毒理學等研究常用的模式生物。”
這種小魚所發揮的最重要作用恐怕要數替人類試藥了。“人們通過培育斑馬魚的突變體,尋找其中患有人類疾病的斑馬魚模型,再用它們進行藥物篩選。”張文清說。
統計顯示,迄今已鑒定有8000多種斑馬魚突變體,其中1/4成為人類疾病模型。它們可模擬多種影響人類健康的重大疾病,比如人類貧血、耳聾、視網膜變性、肌無力症、惡性腫瘤和阿爾茨海默病等。
自上世紀70年代斑馬魚作為模式生物走進實驗室後,科學家一直對它寄予厚望。張文清總結,這是因為它們具有小、多、近、透、快、外等優勢。
它們體型小,僅有3—4釐米,便於養殖,不到30平方米的房間就能養幾萬條;每週產卵數量多,達到幾十到幾百個,可做多種基因變異標本;基因與人類相近,30000個基因中有87%與人類同源,利於人類疾病研究;生長的頭3天完全透明,便於活體觀測;生長快,24小時內大部分器官形成,3個月成年;屬於母體外胚胎發育,可在光鏡下直視。
正因如此,科學家們對斑馬魚本身的研究成果不斷涌現。美國俄勒岡大學神經學研究所利用斑馬魚,來研究脊椎動物神經系統發育;德國發育生物學家Christine Nsslein-Volhard以及美國哈佛大學Wolfgang Driever博士的研究組,展開對斑馬魚進行大規模化學誘變研究,鑒定出約4000種斑馬魚突變體;新加坡分子與細胞生物學研究所研究人員,則致力於研究斑馬魚的肝功能、肌肉神經發育多樣化、發育信號及模式等。
從1980年到2010年權威學術刊物PubMed上收集的有關斑馬魚的研究論文數量看,近30年來科學家對小魚的關注度呈直線上升趨勢。有關的論文從2000年的625篇,增至2010年的1879篇。張文清表示,如今,平均每月就有四五篇關於斑馬魚的研究論文在世界性期刊發表。
2
藥物篩選
目前篩藥絕大多數是細胞篩藥模式,把藥物作用在細胞上,發現有效果的再作用到動物身上,但實驗結果顯示通過細胞篩選的絕大多數藥物對動物無效
我們熟知的資訊是,人類與黑猩猩的同源性超過了95%,在基因數、基因結構與功能、染色體與基因組構造上,人類和黑猩猩幾乎相同。但人類和黑猩猩實際上存在著根本區別。而且,這類大動物要作為科研中的模式生物有著成本高、生長週期長等各種限制。小動物和昆蟲等簡單生物更為適合作模式生物。
其實早在一百多年前,生物學家就開始利用簡單生物來理解生命世界一般規律的意義。在進化支流的港灣中休憩的小生命——酵母、線蟲、果蠅、海膽、擬南芥、斑馬魚、非洲爪蟾、小鼠,都是模式生物的代表。
比如,科學家們通過海膽精卵表面分子的特異性識別、精子頂體反應、卵皮質反應等現象,研究受精生物學;生命週期僅三天的線蟲為人類不間斷觀察並追蹤每個細胞的演變提供了可能;繁殖迅速、染色體巨大的果蠅揭示了遺傳規律,並讓科學家三次獲得諾貝爾獎;非洲爪蟾的卵母細胞體積大、數量多,易於顯微操作,開啟了細胞週期調控的分子機理之門;當今世界上研究得最詳盡的哺乳類實驗動物小鼠,甚至讓科學家們獲得了17項諾貝爾獎。
不過,儘管這些模式生物為人類健康事業做出了巨大貢獻,換來了科學家的驕人成績,但不可否認的是,它們各自都存在“先天不足”。尤其是在替人類篩選藥物這一問題上,上述模式生物的缺陷讓科學家頭疼:果蠅和線蟲屬於無脊椎動物,與人類體徵相差較大;爪蟾體積過大,飼養過程漫長,其使用的成本昂貴;而最受青睞的小鼠也存在著飼養環境要求高,以及給藥及觀測難等問題。
如今,利用上述“模式生物”所用的篩藥方式絕大多數是細胞篩藥模式,也就是把藥物作用在細胞上,發現有效果的就再次作用到動物身上。不過,張文清表示,這樣的方法缺陷也非常明顯,“藥物很可能只對細胞有用,放在整體環境中就失效了。比如,生物體內的細胞間可能存在相互作用,藥效很可能在這些過程中被消解。”
即便有效,由於需要觀測到各種基因組合動物的藥後效果,對動物的數量需求很大,“一種藥物就起碼需要幾萬隻小鼠,這需要多大的飼養場所才能支援?!”不僅如此,張文清表示,給藥方式和觀測藥效的過程也困難重重,“怎麼讓小鼠吃藥呢?即便給定了藥量,它能否全吃完呢?藥效如何?在體內產生了怎樣的生物變化?這些都只能先將小鼠殺死再解剖觀測,這意味著,我們就無法觀測到活體變化了。”
張文清說,實驗結果顯示通過細胞篩選的絕大多數藥物對動物無效。
3
小魚走紅
斑馬魚篩藥的特點是“直飛”,沒有“中轉站”,少走彎路,平均每篩250種藥物就有一種能走向市場,有效率是傳統細胞模型藥物篩選辦法的4000倍
張文清是長期致力於利用斑馬魚替人類篩選有效藥物的研究者之一。他告訴記者,利用斑馬魚篩藥有別於傳統的基於細胞模型的藥物篩選方法。“直接將藥注入斑馬魚疾病模型中,觀測是否有效。”
他打了個比方,細胞篩藥就像要轉三次地鐵:第一站是篩選出適合細胞的藥物,第二站轉乘,將藥注入到動物身上,第三站才是檢驗藥物的長期適用性。而斑馬魚篩藥的特點是“直飛”,作用目標明確,效果可評估,沒有“中轉站”。據張文清介紹,由於少走彎路,斑馬魚平均每篩250種藥物就有一種能走向市場,有效率是傳統細胞模型藥物篩選辦法的4000倍。
若往前推一步,讓斑馬魚篩藥得先讓其得病。究竟怎樣才能讓小魚“患病”呢?張文清說:“斑馬魚已經完成了基因測序。這意味著我們可以通過科技手段,先讓魚爸爸隨機基因突變,再讓魚爸爸和一個正常的魚媽媽交配,生下帶有這種突變基因的魚寶寶。然後,我們又讓魚寶寶們各自與兄弟姐妹交配,經過三代,這些小魚就變成了純粹的‘突變體’,可用作實驗了。”
據張文清介紹,目前南方醫科大學的研究人員已獲得66個不同類型的斑馬魚突變體和10個人類重大疾病斑馬魚模型。比如,血管增生的疾病模型有助於今後研發抑制腫瘤的藥物;動脈粥樣硬化的疾病模型,可研發防治高血壓、血脂高的藥物;骨硬化症疾病模型,可篩選治療椎間盤突出的藥物……
儘管近些年國際科學界對斑馬魚的研究與日俱增,但張文清坦言,由於觀念和認識的問題,國內了解斑馬魚的人並不多,研究也進展緩慢。尤其在藥物篩選方面,傳統的細胞模型篩藥方法仍然唱主角,幾乎沒有多少斑馬魚的戲唱。
“其實放眼世界,許多生物學家逐漸意識到了研究斑馬魚的重要性,並加入到這個研究團隊。”張文清說,此前德國生物學家Christine Nsslein-Volhard通過誘變研究闡明果蠅早期發育機制,因此獲得諾貝爾獎。他在發表獲獎感言時就明確表示,今後將致力於斑馬魚研究。
此外,他還透露世界排名前十的制藥公司如諾華、輝瑞、羅氏和阿斯利康等公司也已建立了自己的斑馬魚藥物篩選實驗室或與知名的斑馬魚研究團隊合作建立了高通量新藥開發技術平臺,並取得一定成果。
張文清認為,接下來的工作重點有必要將斑馬魚模式生物學與其他生物學、基礎醫學、臨床醫學、(中)藥學等結合,構建基於人類疾病斑馬魚模型的高通量藥物篩選重點實驗室。
他還透露,斑馬魚很快就要在我國進軍科普宣傳的動漫業。“由於斑馬魚的體態形象很有特點,也十分具有觀賞性,國家接下來將製作它的動漫形象用於科普宣傳。”相信不久之後,這可愛的小生命也能像《海底總動員》裏的小丑魚“尼莫”一樣成為大明星。
科技最前沿
癌症疫苗起效
患者延命數月
數十年來,癌症專家為患者提供的治療手段主要有三種:手術治療、化療和放療,有些癌症倖存患者將這套鐵三角療法形象地稱為“尖刀、毒藥和烙鐵”。
很久之前,研究人員就猜測,如果能弄清如何刺激機體自身的免疫系統來更有力地對抗惡性腫瘤,他們就將新添一種可以顯著地提高癌症患者生存機會,卻又不產生嚴重副作用的武器。但是數十年來,這一領域的研究遭遇了一次又一次的失敗。
在本世紀最初的十年裏,研究人員對各種與疫苗相關的治療方案進行了大量的臨床實驗,但似乎都沒有奏效。人們開始覺得,長期以來一直盼望的那種通用型廣譜抗癌武器恐怕是不可能找到了。
事情並未到此為止。2010年夏天,FDA批准了第一種用於治療癌症的疫苗,這預示著在激發免疫系統來抗癌的研究中,出師不利和陷入絕境的時代可能已經過去了。這種名為“Provenge”的藥物雖然不能治愈癌症,但與標準的化療協同使用後,它已經使數百名晚期前列腺癌患者的生命延長了數月。
這一峰迴路轉,得益於科學家對一些基礎性假設的重新審視,包括免疫系統如何對抗癌細胞,以及癌細胞如何反抗免疫攻擊。
如今,癌症研究人員謹慎而樂觀地認為,我們能夠研發出更多的能特異性增強免疫的療法,新的療法將可以常規性地與手術治療、化療和放療聯合使用以征服癌症,而由此引發的副作用最多只相當於一次重感冒。
人們熟知的大部分疫苗,是在第一時間阻斷那些可能造成大腦損害(麻疹)、癱瘓(脊髓灰質炎)或肝癌(乙肝病毒)的特定感染,以免產生嚴重後果。與此不同的是,治療性癌症疫苗能夠訓練機體識別並摧毀機體組織內既有的癌細胞,並且在治療結束後能長期保持對惡性腫瘤細胞的殺傷作用。
研發這樣的疫苗,說起來容易做起來難。大部分預防性疫苗能激發一種簡單的抗體反應,通常能有效應對多種感染。比如對於流感病毒,抗體只須黏附在病毒上就可以阻止它們感染細胞。但是,通常情況下,抗體反應不足以殺死癌細胞。
從根本上說,構建癌症疫苗需要三個要素。第一是決定一種惡性腫瘤中應該被免疫系統識別為外源物和殺傷靶標的具體分子特徵(即抗原)。第二是決定如何向免疫系統中導入能夠推動免疫系統攻擊癌細胞的起動因子(即疫苗)。第三則是決定針對哪些癌症患者以及在發病過程中的哪個階段注射疫苗。
FDA批准的藥物Provenge的製造商Dendreon公司的路線,是直接向一種被稱為樹突狀細胞的免疫細胞提供特異性靶標。樹突狀細胞遍佈全身,特別是在與外界接觸的組織中(如皮膚和消化道的表面)。樹突狀細胞就像免疫系統的“哨兵”,會向T細胞警告機體出現問題了。不過,免疫細胞只能從遺傳背景完全相同的其他免疫細胞那裏接受指令,因此必須從每個患者體內單獨提取樹突狀細胞,經癌細胞特異性蛋白處理後再回輸到體內——這種治療的一個完整療程所需費用大約是93000美元。副作用包括寒戰、發燒、頭痛,少數情況下會出現中風。一次短期臨床實驗證明,採用Provenge治療的晚期前列腺癌患者的平均生存時間比未接受治療的患者至少長4個月。
不過,我們發現不能用評價放療和化療的標準來衡量免疫療法的抗癌效果。放療和化療見效很快——在幾週之內腫瘤縮小就說明治療有效,否則就是無效。但是,幾個臨床實驗的數據表明,在用癌症疫苗進行治療後,免疫系統可能需要一年的時間才能真正表現出持續性的抑制腫瘤生長的效果。
儘管存在這些障礙和複雜因素,但是研究結果給出的信號是明確的:患者自身的免疫系統可以被有效地增強,用以對抗癌症。這給學術界和產業界那些已經面對太多挫折的研究者帶來了巨大的鼓舞。
撰文 埃裏克·馮·霍夫
翻譯 胡晨博士 浙江大學醫學院 (見報文章有刪節)
美國食品及藥品管理局(FDA)批准的首支治療性癌症疫苗——用於治療前列腺癌的Provenge,以及多種通過增強免疫系統來對抗癌症的藥物在臨床實驗中取得了良好的結果。這一切都表明我們正在進入癌症疫苗研發的新紀元,治療性癌症疫苗在下一個十年裏必將扮演非常重要的角色。
(責任編輯:劉陽禾)
Source: 南方日報